Як працуе літый-іённы акумулятар для электрамабіля?
Убачыўшы ў іншым артыкуле працу свінцовай батарэі, якой абсталяваны ўсе аўтамабілі, давайце зараз разгледзім прынцып працы электрамабіля і асабліва яго літыевую батарэю…

князь
Як і ў любым тыпе батарэі, прынцып застаецца аналагічным: а менавіта: генераваць энергію (тут электрычнасць) у выніку хімічнай ці нават электрычнай рэакцыі, таму што хімія заўсёды побач з электрычнасцю. Фактычна, самі атамы складаюцца з электрычнасці: гэта электроны, якія круцяцца вакол ядра і якія ў некаторым родзе ўтвораць "абалонку" атама ці нават яго "скуру". Ведаючы таксама, што вольныя электроны - гэта лятучыя кавалачкі скуры, якія праводзяць свой час, пераходзячы ад аднаго атама да іншага (не прымацоўваючыся да яго), гэта толькі ў выпадку праводзяць матэрыялаў (залежыць ад колькасці пластоў электронаў і колькасці электронаў на апошні снарад).
Затым мы возьмем «кавалак скуры» з атамаў (а значыць, частка яго электрычнасці) з дапамогай хімічнай рэакцыі, каб атрымаць электрычнасць.

асновы
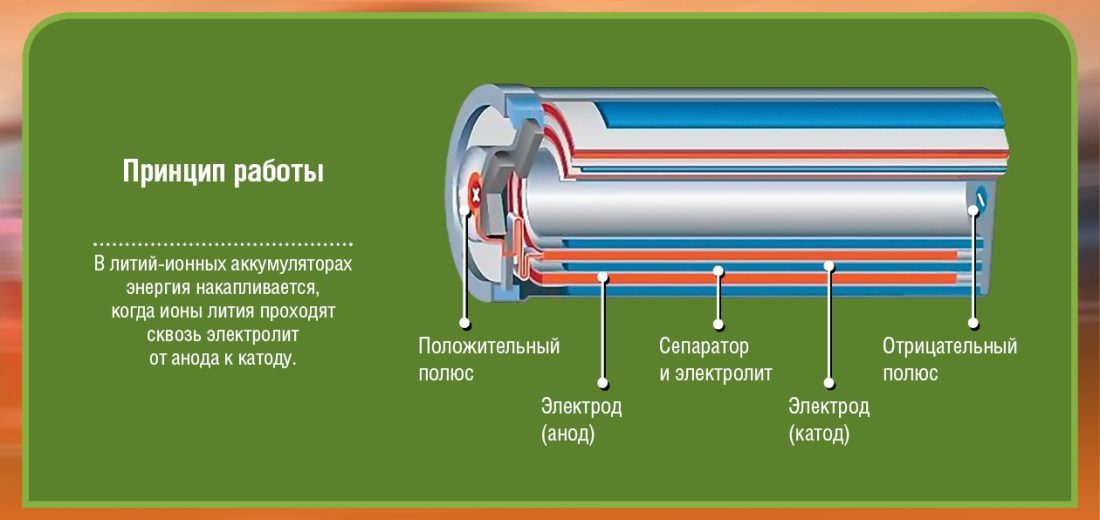
Перш за ўсё, ёсць два полюса (электроды), якія мы называем катод (+ тэрмінал: у аксідзе літыя-кобальту) і анод (тэрмінал -: вуглярод). Кожны з гэтых палюсоў складаецца з матэрыялу, які альбо адхіляе электроны (-), альбо прыцягвае (+). Усё заліта электраліт што зробіць магчымай хімічную рэакцыю (перанос матэрыялу з анода на катод) у выніку генерацыі электрычнасці. Паміж гэтымі двума электродамі (анодам і катодам) устаўлены бар'ер, каб пазбегнуць кароткага замыкання.
Звярніце ўвагу, што батарэя складаецца з некалькіх ячэек, кожная з якіх утворана тым, што відаць на схемах. Калі, напрыклад, я назапашваю 2 вочкі па 2 вольта, у мяне на вынахадзе батарэі будзе ўсяго 4 вольта. Каб прывесці ў рух машыну масай у некалькі сотняў кг, прадстаўце, колькі трэба вочак…
Што адбываецца на палігоне?
Справа гэта атамы літыя. Яны прадстаўлены ў дэталях: жоўтае сэрца ўяўляе пратоны, а зялёнае - электроны, вакол якіх круцяцца.
Калі акумулятар цалкам зараджаны, усе атамы літыя знаходзяцца на анодным (-) боку. Гэтыя атамы складаюцца з ядра (які складаецца з некалькіх пратонаў), мелага дадатную электрычную сілу 3, а электронаў 3, каб мець адмоўную электрычную сілу 1 (усяго 3, таму што 3 X 1 = 3). . Такім чынам, атам устойлівы з 3 дадатнымі і 3 адмоўнымі (ён не прыцягвае і не адхіляе электроны).
Мы адрываем электрон ад літыя, які аказваецца толькі з двума: затым ён прыцягваецца да + і праходзіць праз перагародку.
Калі я ўсталёўваю кантакт паміж клемамі + і – (таму, калі я выкарыстоўваю батарэю), электроны будуць перамяшчацца ад клемы – да клемы + па электрычным провадзе, вонкавым па стаўленні да батарэі. Аднак гэтыя электроны паходзяць з «валаса» атамаў літыя! Па сутнасці, з 3-х электронаў, якія верцяцца вакол, 1 адарваны, а ў атама застаецца толькі 2. Раптам яго электрычная сіла больш не ўраўнаважваецца, што таксама выклікае хімічную рэакцыю. Адзначым таксама, што атам літыя становіцца іённы літый + таму што зараз ён дадатны (3 – 2 = 1 / Ядро варта 3, а электроны 2, бо мы страцілі адзін. Складанне дае 1, а не 0, як раней. Таму ён больш не нейтральны).
Хімічная рэакцыя, якая ўзнікае ў выніку дысбалансу (пасля разрыву электронаў, каб атрымаць ток), будзе мець следствам адпраўку іён літыя + да катода (клема +) праз сценку, прызначаную для ізаляцыі за ўсё. У рэшце рэшт, электроны і іёны + аказваюцца на баку +.
Па заканчэнні рэакцыі батарэя разраджана. Цяпер ёсць баланс паміж клемамі + і -, які зараз прадухіляе электрычнасць. Па сутнасці, прынцып складаецца ў тым, каб выклікаць дэпрэсію на хімічным / электрычным узроўні, каб стварыць электрычны ток. Мы можам разглядаць гэта як раку, чым больш яна нахіленая, тым важней будзе інтэнсіўнасць бягучай вады. З іншага боку, калі рака плоская, яна больш не будзе цечу, што азначае разраджаную батарэю.
Падзарадзіць?
Падзарадка складаецца ў звароце працэсу шляхам упырсквання электронаў у кірунку - і выдаленні большай колькасці шляхам усмоктвання (гэта трохі падобна на тое, каб папоўніць ваду ракі, каб зноў выкарыстоўваць яе струмень). Такім чынам, у акумулятары ўсё аднаўляецца, як было да яго разрадкі.
У асноўным, калі мы разраджаны, мы выкарыстоўваем хімічную рэакцыю, а калі мы перазараджваем, мы вяртаем арыгінальныя рэчы (але для гэтага вам патрэбна энергія і, такім чынам, зарадная станцыя).
Насіць?
Літыевыя батарэі зношваюцца хутчэй, чым старыя добрыя свінцова-кіслотныя батарэі, якія стагоддзямі выкарыстоўваліся ў нашых аўтамабілях. Электраліт мае тэндэнцыю да раскладання, як і электроды (анод і катод), але таксама варта ўлічваць, што на электродах утворыцца адклад, якое памяншае пераход іёнаў з аднаго боку на іншую… Адмысловыя прылады дазваляюць аднаўляйце скарыстаныя батарэі, разраджаючы іх адмысловай выявай.
Колькасць магчымых цыклаў (разрад + поўная падзарадка) ацэньваецца прыкладна ў 1000-1500, так што з паўперыядам пры падзарадцы ад 50 да 100% замест 0 да 100%. Нагрэў таксама моцна пашкоджвае літый-іённыя батарэі, якія маюць тэндэнцыю награвацца, калі ад іх спажываецца занадта шмат энергіі.
Чытайце таксама: як захаваць акумулятар у маім электрамабілі?
Магутнасць рухавіка і акумулятар…
У адрозненне ад цеплавізара, на магутнасць уплывае не паліўны бак. Калі ў вас рухавік магутнасцю 400 л.з., тая наяўнасць 10-літровага бака не перашкодзіць вам атрымаць 400 л.з., нават калі гэта будзе на вельмі кароткі час… Для электрамабіля гэта зусім не тое ж самае.! Калі акумулятар недастаткова магутны, рухавік не зможа працаваць на поўную магутнасць … Так ідзе справу з некаторымі мадэлямі, дзе рухавік ніколі не можа быць даведзены да мяжы (акрамя выпадкаў, калі ўладальнік важдаецца і дадае акумулятар вялікага калібра!).
Цяпер даведаемся: як працуе ЭЛЕКТРЫЧНЫ РУХАВІК
Усе каментары і рэакцыі
Дернье каментар апублікаваны:
Мао (Дата: 2021 г., 03:03:15)
вельмі добрая праца
Іл Дж. 1 рэакцыя (і) на гэты каментар:
- Адміністратар АДМІНІСТРАТАР САЙТА (2021-03-03 17:03:50): Гэты каментар нават лепш 😉
(Ваш пост будзе бачны пад каментаром пасля праверкі)
напісаць каментар
Як вы ставіцеся да заяўленых вытворцамі лічбаў спажывання?
